アフェレシスデバイス

血球細胞除去用浄化器 アダカラム
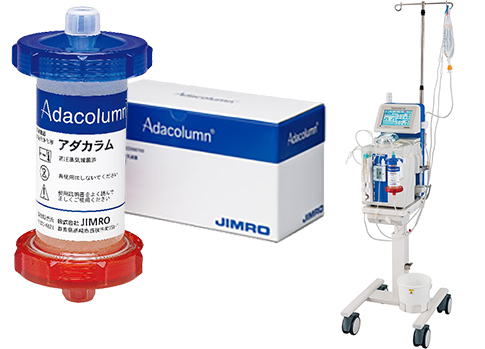
アダカラムは、潰瘍性大腸炎、クローン病、膿疱性乾癬、乾癬性関節炎および敗血症の治療に使われる医療機器で、 体外循環法により末梢血から主に顆粒球・単球を吸着除去します。
本品は、血液から顆粒球・単球を吸着除去する目的で用いられます。
体外循環によって、患者血液を酢酸セルロース製ビーズが充填されたカラムに通過させ、一部の顆粒球・単球が吸着・除去された血液を再び患者の体内へ返します。
最小梱包単位:1 本/ 箱
輸送包装単位:5 本/ 箱
本品は、直射日光の当たる場所、高温となる場所、振動の激しい場所及び凍結する可能性のある場所を避け清潔な室内で保管してください。
本体および外箱に使用期限が記載されています(滅菌後2年)。
21100BZZ00687000 平成11 年10 月29 日
平成20年9月2日:クローン病に対する適応追加
平成24年6月25日:膿疱性乾癬に対する適応追加
令和元年6⽉10⽇:乾癬性関節炎に対する適応追加
令和3年7月14日:潰瘍性大腸炎の寛解維持に対する適応追加
令和6年11月1日:敗血症に対する適応追加
平成24年12月6日:潰瘍性大腸炎
平成30年11月2日:クローン病
<膿疱性乾癬> 再審査申請中
<乾癬性関節炎> 使⽤成績評価申請中
敗血症が保険適用となりました
2025年8月1日より、敗血症が保険適用となりました。保険内容につきましては、「保険について」をご覧下さい。
潰瘍性大腸炎の寛解維持が保険適用となりました
2022年1月1日より、潰瘍性大腸炎の寛解維持が保険適用となりました。保険内容につきましては、「保険について」をご覧下さい。
アダカラムはCEマークを取得しています
対象疾患は、潰瘍性大腸炎・クローン病・関節リウマチ*・眼症状を有するベーチェット病*・全身性エリテマトーデス*・膿疱性乾癬です。
*日本では未承認
主要文献
1) 柏木伸仁、他 : 顆粒球・活性酸素と炎症反応の調節. 活性酸素フリーラジカル. 6: 77‐92, 1995
2) Kashiwagi N, et al.: A role for granulocyte and monocyte apheresis in the treatment of rheumatoid arthritis. Ther Apher. 2: 134‐141, 1998
PMID: 10225715
3) 下山 孝、他 : 潰瘍性大腸炎の最近の進歩‐体外循環を応用する白血球除去療法‐活動期における顆粒球吸着療法‐多施設共同 無作為割付比較試験‐. 日本アフェレシス学会雑誌 . 18: 117‐131, 1999
4) 澤田康史、他 : 顆粒球吸着による潰瘍性大腸炎治療機器(アダカラム). 臨床消化器内科. 15: 1803-1806, 2000
5) 鈴木康夫、他 : ビーズを用いた白血球系細胞除去療法 活動期潰瘍性大腸炎に対する顆粒球吸着療法の有効性について. 日本ア フェレシス学会雑誌 . 19: 17-23, 2000
6) Shimoyama T, et al.: Safety and efficacy of granulocyte and monocyte adsorption apheresis in patients with active ulcerative colitis; a multicenter study. J Clin Apher. 16: 1-9, 2001
PMID: 11309823
7) 鈴木康夫、他 : 潰瘍性大腸炎に対する顆粒球吸着療法の効果と機序に対する考察 .日本アフェレシス学会雑誌 . 20: 17-26, 2001
8) Kashiwagi N, et al.: Immunomodulatory effects of granulocyte and monocyte adsorption apheresis as a treatment for patients with ulcerative colitis. Dig Dis Sci. 47: 1334-1341, 2002
PMID: 12064810
9) Tsukada Y, et al.: Cytokine profile in colonic mucosa of ulcerative colitis correlates with disease activity and response to granulocytapheresis. Am J Gastroenterol. 97: 2820-2828, 2002
PMID: 12425554
10) Hanai H, et al.: Leukocyte adsorptive apheresis for the treatment of active ulcerative colitis: a prospective, uncontrolled, pilot study. Clin Gastroenterol Hepatol. 1: 28-35, 2003
PMID: 15017514
11) Tomomasa T, et al.: Granulocyte adsorptive apheresis for pediatric patients with ulcerative colitis. Dig Dis Sci. 48: 750-754, 2003
PMID: 12741466
12) Naganuma M, et al.: Granulocytapheresis is useful as an alternative therapy in patients with steroid-refractory or -dependent ulcerative colitis. Inflamm Bowel Dis. 10: 251-257, 2004
PMID: 15290920
13) Yamamoto T, et al.: Granulocyte and monocyte adsorptive apheresis in the treatment of active distal ulcerative colitis : a prospective, pilot study. Aliment Pharmacol Ther. 20:783-792, 2004
PMID: 15379839
14) Kanke K, et al.: Clinical evaluation of granulocyte/monocyte apheresis therapy for active ulcerative colitis. Dig Liver Dis . 36: 811-817, 2004
PMID: 15646427
15) 松井敏幸、他 : 白血球系細胞除去療法によるCrohn 病の治療. 胃と腸 . 39: 200-215, 2004
16) Fukuda Y, et al.: Adsorptive granulocyte and monocyte apheresis for refractory Crohn's disease : an open multicenter prospective study. J Gastroenterol. 39: 1158-1164, 2004
PMID: 15622479
17) Suzuki Y, et al.: Selective granulocyte and monocyte adsorptive as a first -line treatment for steroid naive patients with active ulcerative colitis: a prospective uncontrolled study. Dig Dis Sci. 49: 565-571, 2004
PMID: 15185858
18) Takeda Y, et al.: Adhesion dependent release of hepatocyte growth factor and interleukin-1 receptor antagonist from human blood granulocytes and monocytes: evidence for the involvement of plasma IgG, complement C3 and β2 integrin. Inflamm Res. 53: 277-283, 2004
PMID: 15241561
19) Hanai H, et al.: Adsorptive granulocyte and monocyte apheresis versus prednisolone in patients with corticosteroiddependent moderately severe ulcerative colitis. Digestion. 70: 36-44, 2004
PMID: 15297776
20) Muratov V, et al.: Down-regulation of interferon-γ parallels clinical response to selective leukocyte apheresis in patients with inflammatory bowel disease: a 12-month follow-up study. Int J Colorectal Dis. 21: 493-504, 2006
PMID: 16538495
21) Yamamoto T, et al.: Impact of selective leukocytapheresis on mucosal inflammation and ulcerative colitis: cytokine profiles and endoscopic findings. Inflamm Bowel Dis. 12: 719-726, 2006
PMID: 16917227
22) Ljung T, et al.: Granulocyte, monocyte/macrophage apheresis for IBD. The first 100 patients treated in Scandinavia. Scand J Gastroenterol. 42: 221-227, 2007
PMID: 17327942
23) Hanai H, et al.: Intensive granulocyte and monocyte adsorption versus intravenous prednisolone in patients with severe ulcerative colitis: An unblended randomized multi-centre controlled study. Dig Liver Dis. 40: 433-440, 2008
PMID: 18296130
24) Tanaka T, et al.: In patients with ulcerative colitis, adsorptive depletion of granulocytes and monocytes impacts mucosal levels of neutrophils and clinically is most effective in steroid naive patients. Dig Liver Dis. 40: 731-736, 2008
PMID: 18387860
25) Sakuraba A, et al.: A pilot open-labeled prospective randomized study between weekly and intensive treatment of granulocyte and monocyte adsorption apheresis for active ulcerative colitis. J Gastroenterol. 43: 51-56, 2008
PMID: 18297436
26) Sakuraba A, et al.: An open-label prospective randomized multicenter study shows very rapid remission of ulcerative colitis by intensive granulocyte and monocyte adsorptive apheresis as compared with routine weekly treatment. Am J Gastroenterol. 104: 2990-2995, 2009
PMID: 19724269
27) Kanekura T, et al.: Treatment of pustular psoriasis with granulocyte and monocyte adsorption apheresis. J Am Acad Dermatol. 49: 329-332, 2003
PMID: 12894091
28) Kanekura T, et al.: Granulocyte and monocyte adsorption apheresis (GCAP) for refractory skin diseases caused by activated
neutrophils and psoriatic arthritis: evidence that GCAP removes Mac-1-expressing neutrophils. Ther Apher Dial. 10: 247-256, 2006
PMID: 16817789
29) Seishima M, et al.: Efficacy of granulocyte and monocyte adsorption apheresis for pustular psoriasis. Ther Apher Dial. 12: 13-18, 2008
PMID: 18257807
30) Fujisawa T, et al.: Generalized pustular psoriasis successfully treated with granulocyte and monocyte adsorption apheresis. Ther Apher Dial. 15: 374-378, 2011
PMID: 21884472
31) Shukuya R, et al.: Granulocyte and monocyte adsorption apheresis for generalized pustular psoriasis. J Dermatol. 38: 1130-1134, 2011
PMID: 22007872
32) Furusawa K, et al.: Immunosuppressant and infliximab-resistant generalized pustular psoriasis successfully treated with granulocyte and monocyte adsorption apheresis. Ther Apher Dial. 16: 379-380, 2012
PMID: 22817129
33) Fujisawa T, et al.: Adsorptive depletion of CD14+ CD16+ proinflammatory monocyte phenotype in patients with generalized pustular psoriasis: clinical efficacy and effects on cytokines. Ther Apher Dial. 16: 436-444, 2012
PMID: 23046368
34) Ikeda S, et al.: Therapeutic depletion of myeloid lineage leukocytes in patients with generalized pustular psoriasis indicates a major role for neutrophils in the immunopathogenesis of psoriasis. J Am Acad Dermatol. 68: 609-617, 2013
PMID: 23332516
35) Yoshimura N, et al.: An open-label prospective randomized multicenter study of intensive versus weekly granulocyte and monocyte apheresis in active Crohn’s disease. BMC Gastroenterology. 15: 163, 2015
PMID: 26585569
36) Kanekura T, et al.: Therapeutic depletion of myeloid lineage leukocytes by adsorptive apheresis for psoriatic arthritis: Efficacy of a non-drug intervention for patients refractory to pharmacologics. J Dermatol. 44: 1353–1359, 2017
PMID: 28771892
37) Naganuma M, et al.: Efficacy of apheresis as maintenance therapy for patients with ulcerative colitis in an open-label prospective multicenter randomised controlled trial. J Gastroenterol. 55: 390-400, 2020
PMID: 31811562
38) Nishida O, et al.: Granulocyte and Monocyte Adsorption Therapy in Patients With Sepsis: A Feasibility Study. Artif Organs. 49: 852-863, 2025
PMID: 39825588